Виды оснований. Классификация оснований
Основанием принято считать некую основополагающую материальную структуру (поверхность), на которой в будущем будут установлены (смонтированы, нанесены) какие-либо строения, их составляющие, технические приспособления, инженерные конструкции и пр. Видов оснований великое множество, и все они разнятся по применению, то есть по тому, что на них будет размещено в процессе строительства (монтажа) инженерных или технических сооружений (приспособлений).
Разновидности оснований в архитектуре

В строительстве каждый сегмент работ по возведению здания базируется на своем основании. Самыми значимыми здесь являются:
- Под фундамент. Перед строительством любого архитектурного сооружения специалисты тщательно исследуют грунт, на котором этому сооружению придется стоять долгие годы. И именно от того, какими качествами будет обладать грунт, будет зависеть выбор фундамента, на котором это здание будет возводиться.
- Под трубы канализации и прочие инженерные сооружения. Чаще всего это все тот же грунт, на котором будет возводиться строение.
- Под несущие стены. После возведения фундамента он автоматически является основанием под несущие стены строения.
- Под полы. Основанием для полов первого этажа может служить перекрытие цокольного этажа, для последующих этажей – потолочные перекрытия предыдущих этажей.
- Под кровлю. В большинстве случаев им являются несущие стены строения.
- Под штукатурку. В качестве него выступают внутренние и внешние площади несущих стен и межкомнатных перегородок.
Говоря простыми словами, несмотря на то, что находится перед вами, оно всегда держится на чем-то, что и является его основанием. А теперь поговорим о разновидностях оснований в архитектуре более подробно.
Основания под фундамент

Разновидностей фундаментов множество, и это неспроста. Каждый из фундаментов рассчитан на свою основу. Виды оснований под фундаменты различаются по степени их:
- несущей способности;
- сжатия;
- пучинистости;
- вымываемости и растворимости под воздействием грунтовых вод;
- промерзания;
- просадки и предрасположенности к оползням.
Именно на основании перечисленных факторов и выбирается тип фундамента, на котором будет воздвигаться строение. Типы грунтов, то есть оснований под строения, подразделяются на:
- Хрящевой – отлично подходящий для возведения строения на мелкозаглубленном ленточном фундаменте. Его состав – глина и песок с примесями щебня. Он почти не вымывается и дает малую осадку.
- Песчаный – подходит для любых ленточных фундаментов, в том числе и блочных. Песок – превосходное основание, отлично трамбующееся и пропускающее влагу. Все это делает его плотным и надежным, поэтому будущее здание на такой основе можно возводить и на столбчатом фундаменте.
- Скалистый – самый крепкий и надежный из всех. Подойдет для любых типов фундамента.
- Глинистый – самый пучинистый грунт. Для такого в самый раз будет ленточный или плитный фундамент.
- Болотистый – никакой тип фундамента, кроме свайного, здесь не подойдет. Желательно использовать винтовые сваи.
- Торфяной – тоже слабоватый грунт. На таких неустойчивых и плавающих основаниях лучше всего будет остановиться на плитном фундаменте.
Основания под трубопроводы
В зависимости от разновидностей грунта виды оснований под трубопроводы подразделяются на:
- Песчаные.
- Бетонные.
- Железобетонные.

В случае со скальными, супесчаными, суглинистыми и сухими глинистыми почвами основание под трубы прокладывают 15-сантиметровой песчаной, хорошо утрамбованной постелью.
Если грунт высокопластичен, как в случае с некоторыми разновидностями глинистых и суглинистых разновидностей, постоянно в избытке пропитанных влагой, понадобится обязательная укладка бетонных плит и стула (угол охвата 135°).
Прокладка трубопроводов в свеженасыпных грунтах, равно как в грунтах с ожидаемой и непредсказуемой осадкой, требует заделку основания из железобетонных подушек.
Основания под несущие стены

Виды оснований под несущие стены напрямую зависят от конструктивных особенностей фундамента, поскольку, по сути, он и служит им основой. В зависимости от его разновидностей, а также от веса здания, несущие стены начинают возводиться:
- в случае с ленточным фундаментом – непосредственно на стены (ребра) самого ленточного фундамента;
- в случае с плитным – на плиту;
- в случае со столбчатым или свайным фундаментом монтируется ростверк, и стены возводятся уже на него.
Виды оснований под брусчатку могут быть бетонными (железобетонный ростверк) или металлическими. Многие и вовсе возводят деревянный свайный фундамент с деревянным же ростверком.
Основания под полы
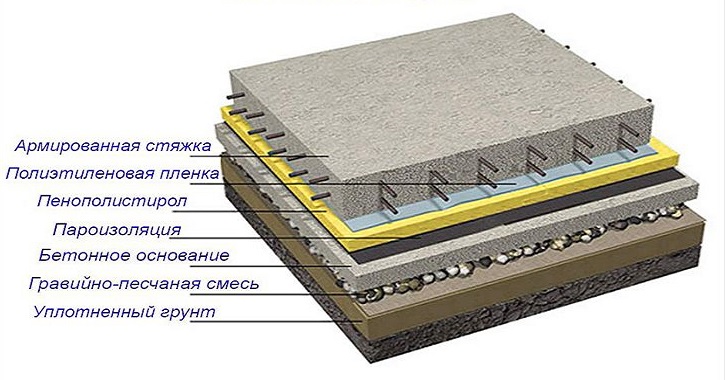
Видов оснований под полы бывает множество, но все они сводятся к схеме следующего характера:
- Утрамбованный грунт, на который распределена прослойка из гравийно-песчаной смеси, также тщательно утрамбованная.
- Черновая бетонная основа небольшой ширины.
- Слой паро-, гидро- и теплоизоляции. В качестве пароизоляции используются специальные жидкие резины, диффузные мембраны или полиэтиленовая пленка. Многие на этом этапе выбирают строительный толь. В роли теплоизоляции в большинстве случаев выступает пенополистирол, хотя многие опять же могут довольствоваться слоем керамзита. Гидроизоляция – тот же полиэтилен или полипропилен.
- Железобетонная стяжка, которая послужит основанием для основного полового покрытия.
Основания под кровлю
Виды оснований под кровлю напрямую зависят от того, будет ли жилым чердачный этаж, и от видов кровельного материала. В случае если на чердаке будут расположены жилые помещения, крыша должна быть более качественно утеплена и изнутри обустроена так, чтобы служить основанием для внутренней отделки.
В зависимости от упомянутых факторов виды оснований могут быть выполнены с висячими или наслонными стропилами. В первом случае облегченная конструкция может состоять из затяжки, стропил и ригеля. В более прочной конструкции вместо ригеля может быть использована стойка-брус с подкосами.
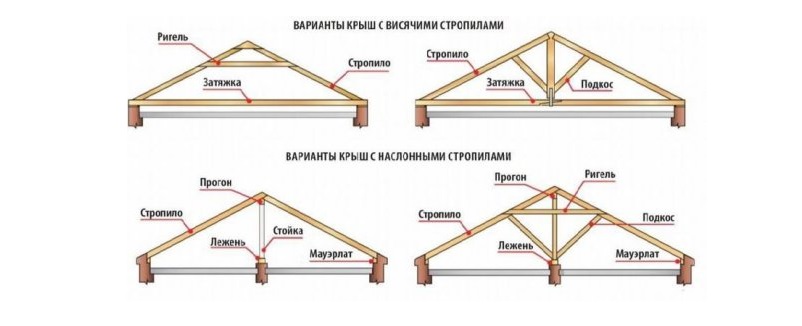
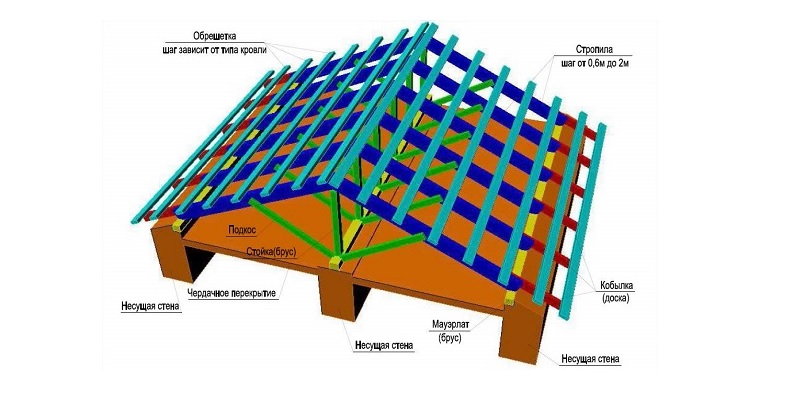
Конструкция основания крыши с наслонными стропилами не обходится без мауэрлатов, лежня, прогона, стойки-бруса и опять же стропил. Более сложная конструкция подразумевает дополнительное усиление ригелем и подкосами. Для укладки кровельного материала, в зависимости от его разновидности, стропила оснащаются обрешеткой. В случае рулонных разновидностей кровельного материала вместо стропил может быть использована доска, набитая вплотную друг к дружке.
Вариант под штукатурку: разновидности
Видов оснований под штукатурку бывает несколько. Все они разнятся в зависимости от материалов и структуры поверхностей, на которые она будет наноситься.

Основные разновидности оснований:
- Поверхность стены, покрытая специальной грунтовкой. Существуют разные виды грунтовок, подходящие как для бетонных, так и для деревянных поверхностей. Все они усиливают сцепление штукатурной смеси с материалом стены или стенного покрытия.
- Поверхность стены, в которой часто сделаны специальные засечки, увеличивающие сцепление штукатурки с материалом этой поверхности. На шероховатый кирпич штукатурка всегда схватывается хорошо. Если же кладка выполнена из гладкого кирпича либо штукатурка будет наноситься на ровную бетонную поверхность, существует большой риск того, что она попросту отслоится от стены и обрушится. Именно для этого и нужны насечки. Они имеют вид продолговатых борозд, глубиной до 0,5 см, выполненных как можно чаще по всей площади стены.
- Поверхность стены, оснащенная армированной сеткой. Сетка, посаженная на дюбели, удержит штукатурку на любой поверхности. Если штукатурка будет наноситься на окрашенные стены, следует применить оба варианта – и засечки, и армированную сетку.
- Поверхность стены, оснащенная тростниковым матом. Такой вид основания используют в домах с саманными, деревянными стенами или перегородками. Тростниковый мат надежно удержит штукатурку на любой из подобных поверхностей.
Заключение
Существуют еще множество разновидностей оснований, например, основание под шпаклевку, под покраску, под обои, но все они базируются на том же принципе – улучшить сцепление отделочных материалов с поверхностью. Кто желает ознакомиться с подготовкой стен к оклеиванию обоев, может посмотреть следующее видео.

Как видно из материала статьи, архитектура не терпит простоты. Все компоненты строения должны быть не только тщательно подогнаны по размеру, но и хорошо скреплены между собой. А поможет это сделать тщательная и правильная подготовка оснований.
Основания: классификация и химические свойства
Основания (гидроксиды) – сложные вещества, молекулы которых в своём составе имеют одну или несколько гидрокси-групп OH. Чаще всего основания состоят из атома металла и группы OH. Например, NaOH – гидроксид натрия, Ca(OH)2 – гидроксид кальция и др.
 Существует основание – гидроксид аммония, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Гидроксид аммония образуется при растворении аммиака в воде (реакции присоединения воды к аммиаку):
Существует основание – гидроксид аммония, в котором гидрокси-группа присоединена не к металлу, а к иону NH4+ (катиону аммония). Гидроксид аммония образуется при растворении аммиака в воде (реакции присоединения воды к аммиаку):
NH3 + H2O = NH4OH (гидроксид аммония).
Валентность гирокси-группы – 1. Число гидроксильных групп в молекуле основания зависит от валентности металла и равно ей. Например, NaOH, LiOH, Al (OH)3, Ca(OH)2, Fe(OH)3 и т.д.
Все основания – твёрдые вещества, которые имеют различную окраску. Некоторые основания хорошо растворимы в воде (NaOH, KOH и др.). Однако большинство из них в воде не растворяются.
Растворимые в воде основания называются щелочами. Растворы щелочей «мыльные», скользкие на ощупь и довольно едкие. К щелочам относят гидроксиды щелочных и щелочноземельных металлов (KOH, LiOH, RbOH, NaOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 и др.). Остальные являются нерастворимыми.
Нерастворимые основания – это амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью ведут себя, как кислоты.
Разные основания отличаются разной способностью отщеплять гидрокси-группы, поэтому признаку они делятся на сильные и слабые основания.
Сильные основания | Слабые основания |
NaOH гидроксид натрия (едкий натр) KOH гидроксид калия (едкое кали) LiOH гидроксид лития Ba(OH)2 гидроксид бария Ca(OH)2 гидроксид кальция (гашеная известь) | Mg(OH)2 гидроксид магния Fe(OH)2 гидроксид железа (II) Zn(OH)2 гидроксид цинка NH4OH гидроксид аммония Fe(OH)3 гидроксид железа (III) и т.д. (большинство гидроксидов металлов) |
Сильные основания в водных растворах легко отдают свои гидрокси-группы, а слабые – нет.
 Химические свойства оснований
Химические свойства оснований
Химические свойства оснований характеризуются отношением их к кислотам, ангидридам кислот и солям.
1. Действуют на индикаторы. Индикаторы меняют свою окраску в зависимости от взаимодействия с разными химическими веществами. В нейтральных растворах – они имеют одну окраску, в растворах кислот – другую. При взаимодействии с основаниями они меняют свою окраску: индикатор метиловый оранжевый окрашивается в жёлтый цвет, индикатор лакмус – в синий цвет, а фенолфталеин становится цвета фуксии.
2. Взаимодействуют с кислотными оксидами с образованием соли и воды:
2NaOH + SiO2 → Na2SiO3 + H2O.
3. Вступают в реакцию с кислотами, образуя соль и воду. Реакция взаимодействия основания с кислотой называется реакцией нейтрализации, так как после её окончания среда становится нейтральной:
2KOH + H2SO4 → K2SO4 + 2H2O.
4. Реагируют с солями, образуя новые соль и основание:
2NaOH + CuSO4 → Cu(OH) 2 + Na2SO4.
5. Способны при нагревании разлагаться на воду и основной оксид:
Cu(OH)2 = CuO + H2O.
Остались вопросы? Хотите знать больше об основаниях?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Основание (химия) — Википедия
У этого термина существуют и другие значения, см. Основание.Основание — химическое соединение, способное образовывать ковалентную связь с протоном (основание Брёнстеда
 )[1]. В узком смысле под основаниями понимают осно́вные гидроксиды — сложные вещества, при диссоциации которых в водных растворах отщепляется только один вид анионов — гидроксид-ионы OH−[2].
)[1]. В узком смысле под основаниями понимают осно́вные гидроксиды — сложные вещества, при диссоциации которых в водных растворах отщепляется только один вид анионов — гидроксид-ионы OH−[2].Частным случаем оснований являются щёлочи — гидроксиды щелочных, щелочноземельных металлов, а также некоторых других элементов, например, таллия. Реакции оснований с кислотами называют реакциями нейтрализации.
Понятие основания сформировалось в XVII веке и было впервые введено в химию французским химиком Гийомом Франсуа Руэлем в 1754 году. Он отметил, что кислоты, известные в те времена как летучие жидкости (например, уксусная или соляная кислоты), превращаются в кристаллические соли только в сочетании с конкретными веществами. Руэль предположил, что эти вещества служат «основаниями» для образования солей в твёрдой форме [3].
Единая теория кислот и оснований была впервые представлена шведским физикохимиком С. Аррениусом в 1887 году. В рамках своей теории Аррениус определял кислоту как вещество, при диссоциации которого образуются протоны H+, а основание — как вещество, дающее при диссоциации гидроксид-ионы OH−[4]. Теория Аррениуса, однако, имела свои недостатки — например, она не учитывала влияние растворителя на кислотно-основное равновесие, а также была неприменима к неводным растворам[5].
В 1924 году Э. Франклином была создана сольвентная теория, согласно которой основание определялось как соединение, которое при диссоциации увеличивает число тех же анионов, которые образуются при диссоциации растворителя[4].
С 1923 года основание стали определять в рамках теорий Брёнстеда — Лоури и Льюиса, которые широко применяются и в настоящее время.
Основание в теории Брёнстеда — Лоури[править | править код]
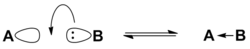
В протонной теории кислот и оснований, выдвинутой в 1923 г. независимо датским учёным Й. Брёнстедом и английским учёным Т. Лоури, основанием Брёнстеда называется соединение или ион, способный принимать (отщеплять) протон от кислоты[6]. Соответственно, кислота Брёнстеда является донором протонов, а взаимодействие кислоты с основанием сводится к передаче протона. При реакции основания Брёнстеда B с кислотой, например, с водой, основание превращается в сопряжённую кислоту BH+, а кислота становится сопряжённым основанием[4]:
B+h3O⇌BH++OH−.{\displaystyle {\mathsf {B+H_{2}O}}\rightleftharpoons {\mathsf {BH^{+}+OH^{-}}}.}
Основание в теории Льюиса[править | править код]
Согласно электронной теории, предложенной в 1923 году американским физикохимиком Г. Льюисом, основание — это вещество, способное отдавать электронную пару на образование связи с кислотой Льюиса[7]. Основаниями Льюиса могут быть амины R3N, спирты ROH, простые эфиры ROR, тиолы RSH, тиоэфиры RSR, анионы, соединения с π-связями[8]. В зависимости от орбитали, на которой расположена участвующая в реакции пара электронов, основания Льюиса подразделяют на n-, σ- и π-типы — электронные пары для этих типов расположены соответственно на несвязывающих, σ- и π-орбиталях[4].
Понятия основания в теориях Льюиса и Брёнстеда — Лоури совпадают: согласно обеим теориям основания отдают пару электронов на образование связи. Разница заключается лишь в том, куда расходуется эта электронная пара. Основания Брёнстеда за её счёт образуют связь с протоном, а основания Льюиса — с любыми частицами, имеющими вакантную орбиталь. Таким образом, существенные различия этих теорий касаются понятия кислоты, а не основания[8][4].
AlCl3+Cl−⇌AlCl4−{\displaystyle {\mathsf {AlCl_{3}+Cl^{-}}}\rightleftharpoons {\mathsf {AlCl_{4}^{-}}}}
BF3+(C2H5)2O⇌BF3⋅(C2H5)2O{\displaystyle {\mathsf {BF_{3}+(C_{2}H_{5})_{2}O}}\rightleftharpoons {\mathsf {BF_{3}\cdot (C_{2}H_{5})_{2}O}}}
Теория Льюиса не предусматривает количественной оценки способности оснований реагировать с кислотами Льюиса. Однако, для качественной оценки широко применяется принцип жёстких и мягких кислот и оснований Пирсона (принцип ЖМКО), согласно которому жёсткие кислоты предпочтительно реагируют с жёсткими основаниями, а мягкие кислоты — с мягкими основаниями. По Пирсону, жёсткими основаниями являются основания, донорный центр которых обладает низкой поляризуемостью и высокой электроотрицательностью[9][10]. Напротив, мягкими основаниями являются донорные частицы с высокой поляризуемостью и низкой электроотрицательностью[10]. Жёсткие и мягкие кислоты обладают такими же свойствами как жёсткие и мягкие основания соответственно с той разницей, что они являются акцепторными частицами[11].
| Жёсткие основания | Промежуточные основания | Мягкие основания |
|---|---|---|
| OH−, RO−, F−, Cl−, RCOO−, NO3−, NH3, RNH2, H2O, ROH, SO42−, CO32−, R2O, NR2−, NH2− | Br−, C6H5NH2, NO2−, C5H5N | RS−, RSH, I−, H−, R3C−, алкены, C6H6, R3P, (RO)3P |
| Жёсткие кислоты | Промежуточные кислоты | Мягкие кислоты |
| H+, Li+, Na+, K+, Mg2+, Ca2+, Al3+, Cr3+, Fe3+, BF3, B(OR)3, AlR3, AlCl3, SO3, BF3, RCO+, CO2, RSO2+ | Cu2+, Fe2+, Zn2+, SO2, R3C+, C6H5+, NO+ | Ag+, Cu+, Hg2+, RS+, I+, Br+, Pb2+, BH3, карбены |
Критерий ЖМКО не имеет количественных параметров, однако основания Льюиса можно приблизительно расположить в ряды по их льюисовской основности. Например, мягкость оснований убывает в следующих рядах[8]:
I−>Br−>Cl−>F−,{\displaystyle {\mathsf {I^{-}>Br^{-}>Cl^{-}>F^{-}}},}
Ch4−>Nh3−>OH−>F−.{\displaystyle {\mathsf {CH_{3}^{-}>NH_{2}^{-}>OH^{-}>F^{-}}}.}
Основание в общей теории Усановича[править | править код]
В общей теории кислот и оснований, созданной М. И. Усановичем в 1939 году, основание определено как вещество, отдающее анионы (или электроны) и принимающие катионы. Таким образом, в рамках теории Усановича в понятие основания входят как основания Брёнстеда, так и основания Льюиса, а также восстановители[5]. Кроме того, само понятие основности, как и кислотности, в общей теории Усановича рассматривается как функция вещества, проявление которой зависит не от самого вещества, а от его партнёра по реакции[13].
Количественное описание силы оснований[править | править код]
Теория Брёнстеда — Лоури позволяет количественно оценить силу оснований, то есть их способность отщеплять протон от кислот. Это принято делать при помощи константы основности Kb — константы равновесия реакции основания с кислотой сравнения, в качестве которой выбрана вода. Чем выше константа основности, тем выше сила основания и тем больше его способность отщеплять протон[8]. Часто константу основности выражают в виде показателя константы основности pKb. Например, для аммиака как основания Брёнстеда можно записать[4][14]:
Nh4+h3O⇌Nh5++OH−{\displaystyle {\mathsf {NH_{3}+H_{2}O}}\rightleftharpoons {\mathsf {NH_{4}^{+}+OH^{-}}}}
Kb=[Nh5+]⋅[OH−][Nh4]=1,79⋅10−5;{\displaystyle K_{b}={\frac {[{\mathsf {NH_{4}^{+}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {NH_{3}}}]}}=1{,}79\cdot 10^{-5};}
pKb=−logKa=4,75.{\displaystyle \ \mathrm {p} K_{b}=-\log K_{a}=4{,}75.}
Для многоосновных оснований используют несколько значений констант диссоциации Kb1, Kb2 и т. д. Например, фосфат-ион может протонироваться трижды:
PO43−+h3O⇌HPO42−+OH−;Kb1=[HPO42−]⋅[OH−][PO43−]=2,10⋅10−2;{\displaystyle {\mathsf {PO_{4}^{3-}+H_{2}O}}\rightleftharpoons {\mathsf {HPO_{4}^{2-}+OH^{-}}};K_{\mathrm {b1} }={\frac {[{\mathsf {HPO_{4}^{2-}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {PO_{4}^{3-}}}]}}=2{,}10\cdot 10^{-2};}
HPO42−+h3O⇌h3PO4−+OH−;Kb2=[h3PO4−]⋅[OH−][HPO42−]=1,58⋅10−7;{\displaystyle {\mathsf {HPO_{4}^{2-}+H_{2}O}}\rightleftharpoons {\mathsf {H_{2}PO_{4}^{-}+OH^{-}}};K_{\mathrm {b2} }={\frac {[{\mathsf {H_{2}PO_{4}^{-}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {HPO_{4}^{2-}}}]}}=1{,}58\cdot 10^{-7};}
h3PO4−+h3O⇌h4PO4+OH−;Kb3=[h4PO4]⋅[OH−][h3PO4−]=1,32⋅10−12.{\displaystyle {\mathsf {H_{2}PO_{4}^{-}+H_{2}O}}\rightleftharpoons {\mathsf {H_{3}PO_{4}+OH^{-}}};K_{\mathrm {b3} }={\frac {[{\mathsf {H_{3}PO_{4}}}]\cdot [{\mathsf {OH^{-}}}]}{[{\mathsf {H_{2}PO_{4}^{-}}}]}}=1{,}32\cdot 10^{-12}.}
Силу основания можно также охарактеризовать константой кислотности его сопряжённой кислоты Ka (BH+), причём произведение константы основности Kb на константу Ka (BH+) равно ионному произведению воды для водных растворов[14] и константе автопротолиза растворителя в общем случае[8].
Ka(Nh5+)=[Nh4]⋅[H+][Nh5+]=5,62⋅10−10;{\displaystyle K_{a}\mathrm {(NH_{4}^{+})} ={\frac {[{\mathsf {NH_{3}}}]\cdot [{\mathsf {H^{+}}}]}{[{\mathsf {NH_{4}^{+}}}]}}=5{,}62\cdot 10^{-10};}
Ka(Nh5+)⋅Kb(Nh4)=Kw=1⋅10−14;{\displaystyle {K_{a}\mathrm {(NH_{4}^{+})} }\cdot {K_{b}\mathrm {(NH_{3})} }=K_{w}=1\cdot 10^{-14};}
pKa(Nh5+)+pKb(Nh4)=pKw=14{\displaystyle {\mathrm {p} K_{a}\mathrm {(NH_{4}^{+})} }+{\mathrm {p} K_{b}\mathrm {(NH_{3})} }=\mathrm {p} K_{w}=14}
Из последнего уравнения также следует, что сила основания тем выше, чем ниже кислотность сопряжённой ему кислоты. Например, вода является слабой кислотой и при отщеплении протона превращается в сильное основание — гидроксид-ион OH−[8].
Значения pKb некоторых оснований и pKa их сопряжённых кислот в разбавленных водных растворах[4]| Формула основания | Формула сопряжённой кислоты | pKb | pKa (BH+) | Формула основания | Формула сопряжённой кислоты | pKb | pKa (BH+) |
|---|---|---|---|---|---|---|---|
| ClO4− | HClO4 | 19 ± 0,5 | −5 ± 0,5 | HPO42− | H2PO4− | 6,80 | 7,20 |
| HSO4− | H2SO4 | 16,8 ± 0,5 | −2,8 ± 0,5 | ClO− | HClO | 6,75 | 7,25 |
| H2O | H3O+ | 15,74 | −1,74 | H2BO3− | H3BO3 | 4,76 | 9,24 |
| NO3− | HNO3 | 15,32 | −1,32 | NH3 | NH4+ | 4,75 | 9,25 |
| HOOC-COO− | (COOH)2 | 12,74 | 1,26 | CN− | HCN | 4,78 | 9,22 |
| HSO3− | H2SO3 | 12,08 | 1,92 | CO32− | HCO3− | 3,67 | 10,33 |
| SO42− | HSO4− | 12,04 | 1,96 | HOO− | H2O2 | 11,62 | 3,38 |
| H2PO4− | H3PO4 | 11,88 | 2,12 | PO43− | HPO42− | 1,68 | 12,32 |
| F− | HF | 10,86 | 3,14 | OH− | H2O | −1,74 | 15,74 |
| NO2− | HNO2 | 10,65 | 3,35 | NH2− | NH3 (ж.) | −19 | 33 |
| CH3COO− | CH3COOH | 9,24 | 4,76 | H− | H2 | −24,6 | 38,6 |
| SH− | H2S | 6,95 | 7,05 | СH3− | СH4 | ~−44 | ~58 |
Влияние растворителя[править | править код]
На кислотно-основное равновесие значительное влияние оказывает растворитель. В частности, для водных растворов было обнаружено, что все основания с константами основности pKb < 0 имеют одинаковые свойства (например, pH растворов). Объясняется это тем, что такие основания в воде практически нацело превращаются в гидроксид-ион OH−, который является единственным основанием в растворе. Так, все основания с pKb < 0 (амид натрия NaNH2, гидрид натрия NaH и др.) дают эквивалентное количество гидроксид-ионов в водных растворах, выравниваясь между собой по силе. Данное явление получило название нивелирующего эффекта растворителя. Аналогичным образом, в водных растворах выравниваются по силе и очень слабые основания с pKb > 14[15][16].
Основания с pKb от 0 до 14 в воде частично протонированы и находятся в равновесии с сопряжённой кислотой, а их свойства в растворе зависят от значения pKb. В этом случае говорят о дифференцирующем эффекте растворителя. Интервал pKb, в котором основания дифференцированы по силе, равен показателю константы автопротолиза растворителя. Для разных растворителей этот интервал различен (14 для воды, 19 для этанола, 33 для аммиака и т. д.), соответственно, и набор дифференцированных и нивелированных оснований для них разный[17].
В растворителях, обладающих выраженными кислотными свойствами, все основания становятся более сильными и большее число оснований нивелируется по силе. Например, уксусная кислота уравнивает большинство известных оснований по силе со своим сопряжённым основанием — ацетат-ионом CH3COO−. Напротив, основные растворители (аммиак) служат дифференцирующими растворителями для оснований[18].
Влияние строения основания[править | править код]
Существует несколько факторов, которые определяют относительную силу органических и неорганических оснований и которые связаны с их строением. Часто несколько факторов действуют одновременно, поэтому трудно предсказать их суммарное влияние. Среди наиболее значимых можно выделить следующие факторы.
- Индуктивный эффект (эффект поля). При повышении доступности электронной пары основания его сила возрастает. По этой причине введение электронодонорных заместителей в основание способствует проявлению им основных свойств. Например, введение алкильных заместителей в молекулу аммиака приводит к более сильным основаниям, чем сам аммиак[19]. Напротив, введение акцепторных заместителей в молекулу понижает силу основания[8].
- Мезомерный эффект (резонансный эффект). Электронодонорные и электроноакцепторные заместители оказывают положительное и отрицательное влияние на силу основания соответственно также через систему сопряжения. В таком случае говорят о мезомерном эффекте. Данный эффект приводит к тем же последствиям, что и индуктивный: различается лишь механизм их действия. Так, пара-нитроанилин является более слабым основанием, чем анилин (pKb равны 12,89 и 9,40 соответственно) из-за акцепторного влияния нитрогруппы, которая снижает доступность электронной пары азота аминогруппы[20].
- Эффект сопряжения проявляется также в том случае, если электронная пара основания находится в системе сопряжения, например, с ароматической системой или двойной связью. В таком случае основания имеют более низкую силу. Например, амиды и анилины являются гораздо более слабыми основаниями, чем амины[19].
- Корреляция с расположением атомов в периодической системе. Чем выше электроотрицательность основного элемента, тем ниже основная сила основания. Так, сила основания понижается при движении по периоду периодической системы слева направо. Также основность понижается при переходе по группе сверху вниз, что связано с увеличением радиуса основного атома и, следовательно, меньшей плотностью отрицательного заряда на нём, что в итоге снижает силу связывания положительно заряженного протона[20].
Ch4−>Nh3−>OH−>F−;{\displaystyle {\mathsf {CH_{3}^{-}>NH_{2}^{-}>OH^{-}>F^{-};}}}
Nh4>Ph4>Ash4{\displaystyle {\mathsf {NH_{3}>PH_{3}>AsH_{3}}}}
- Гибридизация. Сила органических оснований понижается, если основный атом связан с другим атомом кратными связями. Так, при переходе от аминов к иминам и нитрилам основность уменьшается. Это объясняется тем, что электронная пара в этих соединениях располагается на sp3-, sp2— и sp-гибридных орбиталях атома азота соответственно, то есть в данном ряду электронная пара приближается по характеру к s-электронам, приближаясь к атомному ядру и становясь менее доступной[19].
RCh3Nh3>RCH=NH>RC≡N{\displaystyle {\mathsf {RCH_{2}NH_{2}>RCH{=}NH>{RC}{\equiv }{N}}}}
Супероснования[править | править код]
- ↑ 1 2 С одной стороны, наличие третьей алкильной группы в триметиламине и триэтиламине должно увеличивать их основность. С другой стороны, с добавлением третьего заместителя резко уменьшается способность сопряжённых кислот (CH3)3NH+ и (C2H5)3NH+ к гидратации, что уменьшает их устойчивость и суммарно понижает основность аминов.
- ↑ IUPAC Gold Book — base (неопр.). Дата обращения 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ Рудзитис Г. Е., Фельдман Ф. Г. Химия. Неорганическая химия. Органическая химия. 9 класс. — 13-е изд. — М.: Просвещение, 2009. — С. 10. — ISBN 978-5-09-021-625-8.
- ↑ William B. Jensen, The Origin of the Term Base, Journal of Chemical Éducation • 1130 Vol. 83 No. 8 août 2006
- ↑ 1 2 3 4 5 6 7 Химическая энциклопедия / Под ред. И. Л. Кнунянца. — М: Большая Российская энциклопедия, 1992. — Т. 2. — С. 393—395. — ISBN 5-85270-039-8.
- ↑ 1 2 Золотов Ю. А., Дорохова Е. Н., Фадеева В. И. и др. Основы аналитической химии. Книга 1. Общие вопросы. Методы разделения / Под ред. Ю. А. Золотова. — 2-е изд., перераб. и доп. — М: Высшая школа, 1999. — С. 118. — ISBN 5-06-003558-1.
- ↑ IUPAC Gold Book — Brønsted base (неопр.). Дата обращения 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ IUPAC Gold Book — Lewis base (неопр.). Дата обращения 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ 1 2 3 4 5 6 7 8 Москва В. В. Понятие кислоты и основания в органической химии // Соросовский образовательный журнал. — 1996. — № 12. — С. 33—40.
- ↑ IUPAC Gold Book — hard base (неопр.). Дата обращения 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ 1 2 Химическая энциклопедия, 1992, т. 2, с. 145.
- ↑ IUPAC Gold Book — hard acid (неопр.). Дата обращения 18 апреля 2013. Архивировано 30 апреля 2013 года.
- ↑ Золотов и др., 1999, с. 152.
- ↑ Кусаинова К. М. Нет ни кислот, ни оснований! Об одной полузабытой теории и её творце // Химия и жизнь. — 2004. — № 6. — С. 40—44.
- ↑ 1 2 Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Изд. 2-е, испр. и доп. — Ленинград: Химия, 1978. — С. 232—236.
- ↑ Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия. — 3-е изд. — М: Бином. Лаборатория знаний, 2010. — Т. 1. — С. 40. — ISBN 978-5-94774-614-9.
- ↑ Неорганическая химия / Под ред. Ю. Д. Третьякова. — М: Академия, 2004. — Т. 1. — С. 89—94. — ISBN 5-7695-1446-9.
- ↑ Золотов и др., 1999, с. 123—125.
- ↑ Танганов Б. Б. Химические методы анализа. — Улан-Удэ: Издательство ВСГТУ, 2005. — С. 8—14. — ISBN 5-89230-037-4.
- ↑ 1 2 3 4 Сайкс П. Механизмы реакций в органической химии = A Guidebook to Mechanism in Organic Chemistry / Под ред. Я. М. Варшавского. — 3-е изд.. — М: Химия, 1977. — С. 82—91.
- ↑ 1 2 Марч Дж. Органическая химия. Реакции, механизмы и структура. Т. 1 / Пер. с англ. З. Е. Самойловой, под ред. И. П. Белецкой. — М: Мир, 1987. — С. 340—346.
Основания (гидроксиды). Свойства, получение, применение
 Ещё со школы нам известно, что основаниями называют соединения, где атомы металла связаны с одной или несколькими гидроксогруппами — KOH, Ca(OH)2 и т. п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). Основания и кислоты Льюиса мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания (гидроксиды) — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств кислоты — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
Ещё со школы нам известно, что основаниями называют соединения, где атомы металла связаны с одной или несколькими гидроксогруппами — KOH, Ca(OH)2 и т. п. Однако понятие «основания» на самом деле шире, и существует две теории оснований — протонная (теория Брёнстеда — Лоури) и электронная (теория Льюиса). Основания и кислоты Льюиса мы рассмотрим в отдельной статье, поэтому возьмём определение из теории Брёнстеда (далее в данной статье — только основания Брёнстеда): Основания (гидроксиды) — это вещества или частицы, способные принимать (отщеплять) протон от кислоты. Согласно такому определению, свойства основания зависят от свойств кислоты — например, вода или уксусная кислота ведут себя как основания в присутствии более сильных кислот:
H2SO4 + H2O ⇄ HSO4— + H3O+(катион гидроксония)
H2SO4 + CH3COOH ⇄ HSO4— + CH3COOH2+
Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
Fe(OH)2 — гидроксид железа (II)
Fe(OH)3 — гидроксид железа (III)
Существует также основание NH4OH (гидроксид аммония), где гидроксогруппа связана не с металлом, а катионом аммония NH4+.
Классификация оснований
Основания можно классифицировать по следующим признакам:
- По растворимости основания делят на растворимые — щёлочи (NaOH, KOH) и нерастворимые основания (Ca(OH)2, Al(OH)3).
- По кислотности (количеству гидроксогрупп) основания делят на однокислотные (KOH, LiOH) и многокислотные (Mg(OH2), Al(OH)3).
- По химическим свойствам их делят на оснóвные (Ca(OH)2, NaOH) и амфотерные, то есть проявляющие как основные свойства, так и кислотные (Al(OH)3, Zn(OH)2).
- По силе (по степени диссоциации) различают:
а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.
б) слабые (α < 100 %) – все нерастворимые основания Cu(OH)2, Fe(OH)3 и растворимое NH4OH.
Сила оснований
Для оснований можно количественно выразить их силу, то есть способность отщеплять протон от кислоты. Для этого используют константу основности Kb — константу равновесия для реакции между основанием и кислотой, причём в качестве кислоты выступает вода. Чем выше значение константы основности, тем выше сила основания и тем сильнее его способность отщеплять протон. Также вместо самой константы часто используют показатель константы основности pK b. Например, для аммиака NH3 имеем:
Получение
Взаимодействие активного металла с водой:
2Na + 2H2O → 2NaOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Mg + 2H2O Mg(OH)2 + H2
Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4H2O 2NaOH + 2H2 + CI2
Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4.
Физические свойства
Все основания являются твердыми веществами, имеющими различную окраску. В воде нерастворимы, кроме щелочей.
Внимание! Щёлочи являются очень едкими веществами. При попадании на кожу растворы щелочей вызывают сильные долгозаживающие ожоги, при попадании в глаза могут вызвать слепоту. При работе с ними следует соблюдать технику безопасности и пользоваться индивидуальными средствами защиты.

Внешний вид оснований. Слева направо: гидроксид натрия, гидроксид кальция, метагидроксид железа
Химические свойства
Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид – ионов ОН—.
Изменение цвета индикаторов:
фенолфталеин – малиновый
лакмус – синий
метиловый оранжевый – желтый

Фенолфталеин придаёт раствору щёлочи малиновую окраску
Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
2KOH + H2SO4 → K2SO4 + 2H2O,
растворимое
Mg(OH)2 + 2HCI → MgCI2 + 2H2O.
нерастворимое
Взаимодействие с кислотными оксидами:
2KOH + SO3 → K2SO4 + H2O
Взаимодействие с амфотерными оксидами и гидроксидами:
а) при плавлении:
2NaOH + AI2O3 → 2NaAIO2 + H2O,
NaOH + AI(OH)3 → NaAIO2 + 2H2O.
б) в растворе:
2NaOH + AI2O3 +3H2O → 2Na[AI(OH)4],
NaOH + AI(OH)3 → Na[AI(OH)4].
Взаимодействие с некоторыми простыми веществами (амфотерными металлами, кремнием и другими):
2NaOH + Zn + 2H2O → Na2[Zn(OH)4] + H2
2NaOH + Si + H2O → Na 2SiO3 + 2H2
Взаимодействие с растворимыми солями с образованием осадков:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4,
Ba(OH)2 + K2SO4 → BaSO4 + 2KOH.
Малорастворимые и нерастворимые основания разлагаются при нагревании:
Ca(OH)2 → CaO + H2O,
Cu(OH)2 → CuO + H2O.
Назначение и конструкция фундамента как основания зданий
 Не существует сооружения, которое можно было бы возвести непосредственно на грунте.
Не существует сооружения, которое можно было бы возвести непосредственно на грунте.
Ведь за счет собственной, даже небольшой, массы несущих конструкций здание будет неизбежно проседать, а уже через несколько лет появятся трещины в конструкции с дальнейшим полным разрушением.
Поэтому, под зданием нужно обязательно обустраивать специальную конструкцию – основание. Именно оно обеспечит дополнительную жесткость и прочность будущему сооружению.
Фундамент должен обеспечивать:
- Равномерное распределение по грунту массы здания;
- Обеспечение стандартного положения сооружения на почве;
- Стабилизация угловых вертикальных и горизонтальных смещений;
- Жесткость и соединение с несущими элементами здания;
- Снижение негативного влияния самой почвы, а также нивелирование возможных подвижек почвы;
- Защиту внутреннего пространства здания, особенно подвалов, технических этажей, от проникновения грунтовых вод, грызунов;
- Обеспечение оптимального микроклимата внутри сооружения;
- Стабилизацию здания в условиях сейсмической активности.
 Пример фундамента на плавающих грунтах (плавающий фундамент)
Пример фундамента на плавающих грунтах (плавающий фундамент)Поэтому, существует огромное количество различных оснований, которые отличаются конструкцией, характеристиками, сферой применения. Но сначала нужно разобраться, на каких грунтах какие основания используются.
Виды оснований зданий по назначению
- Несущий. Это основной тип фундамента, выполняет задание только передачи нагрузки от здания на грунт, другого назначения нет.
- Комбинированный. Этот уже выполняет не только несущее задание, но и защищает здание от сейсмических толчков, вибрации от магистралей или железнодорожного полотна, паводков и других внешних воздействий. Соответственно, конструкция уже отличается, как и подобранные для такого основания материалы.
- Специальные. К ним относятся сейсмостойкие основания. Они не предназначены для защиты сооружения от вспучивания почвы или воздействия грунтовых вод. А в конструкции имеют специальные наполнители и соединительные группы, которые отвечают за целостность конструкции в целом даже при значительных подвижках почвы. Бывают качающиеся и плавающие. Конструкция каждого типа основания зависит от почвы и сейсмических характеристик территории.
Типы оснований по материалам
 Таблица видов фундаментов
Таблица видов фундаментов- Железобетонный. Выполняется из бетонных материалов, обладает значительной жесткостью и прочностью, стойкий к грунтовым водам и агрессивным средам. Дополнительную прочность и жесткость конструкции дает арматурное наполнение. Арматура играет ключевую роль на первичных этапах возведения здания, ведь бетон получает свои несущие характеристики длительное время, до нескольких лет в зависимости от климата и почвы. Бывает монолитный (единая железобетонная плита) и сборный (делается из сборных заводских блоков, соединенных арматурой и раствором).
- Каменный. Это долговечный фундамент, который можно встретить в старых зданиях, причем он отличается высокой прочностью и отличными техническими характеристиками. Он делается из натурального камня, причем используется материал, характерный для данной территории. Камень соединяется между собой в единое целое с помощью цементного раствора, глины или других материалов.
- Саманный фундамент. Это особенный тип основания, используется на территориях с умеренной влажностью и низким залеганием грунтовых вод. Его особенность в том, что при возведении используются только натуральные материалы, такие как глина и солома. Используется только для небольших жилых зданий, но тут комбинировать саманный кирпич с керамическим кирпичом или блоками нельзя, основание не выдержит нагрузки. Также саманный фундамент нужно дополнительно гидроизолировать, теплоизоляция тут не нужна.
- Деревянный. Для его возведения используют прочную древесину, стойкую к атмосферным воздействиям, грунтовым водам и грызунам. Для таких целей отлично подходит лиственница (она выделяет на открытом воздухе скипидар, который не «любят» грызуны и грибки, а сама древесина консервируется) и дуб (прочный и стойкий к любым воздействиям). Это плавающий тип фундамента, причем выдерживает сильные сейсмические волны, поэтому изх часто можно встретить в горной местности.
- Ячеистобетонный. Этот тип основания набирает популярность через свою дешевизну и скорость возведения. Как правило, в конструкции предусмотрена ячейка для бетонных блоков, они ложатся в шахматном порядке, и медленно поднимается сама конструкция основания.
Влияние грунта на выбор фундамента
 Конструкция любого основания подразумевает передачу всей нагрузки от здания на грунт. Соответственно, состав, характеристики и несущая способность грунта играет ключевую роль при выборе типа и конструкции фундамента для будущего здания. Итак, основания грунтового типа могут быть естественными и природными.
Конструкция любого основания подразумевает передачу всей нагрузки от здания на грунт. Соответственно, состав, характеристики и несущая способность грунта играет ключевую роль при выборе типа и конструкции фундамента для будущего здания. Итак, основания грунтового типа могут быть естественными и природными.
Естественные – это основания, на которых фундаменты возводятся без дополнительного укрепления. А к искусственным относятся основания, которые ложатся на специально создаваемую песчаную подушку. Естественные основания бывают следующих типов: песчаные, глинистые, лессовидные (тут нужно помнить о значительной сейсмической опасности), скальные, супеси и суглинки.
Все почвы, кроме скальных, неизбежно дадут значительную просадку здания, поэтому впоследствии неравномерной нагрузки на грунт в различных местах здания возникают трещины.
Поэтому, самые надежные почвы с точки зрения искусственного возведения оснований, считаются именно скальные.
Глубина заложения основания в зависимости от типа почвы
 Таблица заложения глубины фундамента
Таблица заложения глубины фундаментаГравелистые почвы (скальные породы, возможна комбинация с песком или глиной). Это прочные почвы, не склонные к подвижкам и не сжимаются впоследствии температурного воздействия. Глубина закладки фундамента здания составляет до 1 метра.
- Песчаные почвы. Они пропускают воду, уплотняются при нагрузке и практически не промерзают через отсутствие накопленной влаги. Глубина закладывания составляет до 1 метра, если фракция песчаной смеси составляет 25 мм. При меньшей глубине нужно увеличивать.
- Глинистая почва. Это пучинистый тип почвы, грунт быстро размывается и имеет высокую пластичность. Такой грунт промерзает на значительную глубину, поэтому уровень закладывания фундамента тут должен быть на глубине не менее 25 см ниже граничного уровня промерзания.
- Суглинки и супеси. Это смесь песка и глины, причем содержание глины бывает до 20%. Соответственно, уровень промерзания почвы отличается, поэтому для каждого конкретного случая глубина погружения подбирается индивидуально.
- Лессовые грунты. По внешним характеристикам это глинистые почвы, но отличаются высокой прочностью. При сейсмической активности сдвиг происходит лессовыми пластами, поэтому основание нужно закладывать строго под конкретный шар почвы. Также нужно обязательно проверить, чтобы под верхним слоем грунта не были обнаружены суглинки, которые могут быть лессовым наполнением. Лессовидные грунты могут служить уже как основание для будущего здания, если обеспечить гидроизоляцию подошвы.
Искусственные основания делают на слабых почвах при значительных нагрузках на подошву. К ним часто относят песчано-гравийную подсыпку, различные наполнители и каменистый прочный материал.
Выбор типа фундамента в зависимости от почвы
 Если нужно возводить основание на холмистой местности, тогда сразу нужно рассчитывать боковое давление почвы, возможности горизонтального сдвига и давление почвы по уровню промерзания.
Если нужно возводить основание на холмистой местности, тогда сразу нужно рассчитывать боковое давление почвы, возможности горизонтального сдвига и давление почвы по уровню промерзания.
Величина таких давлений зависит от множества факторов и ее трудно порой рассчитать правильно. Поэтому конструкция оснований на холмах сразу предусматривает как минимум половину запаса прочности.
В таких случаях нужно использовать столбчатые фундаменты, столбы которых соединяются между собой ростверком (железобетонная обвязка). Также тут можно использовать ленточные фундаменты с надежной горизонтальной и вертикальной обвязкой.
- Стационарное основание. Используется при возведении небольших зданий с малой несущей массой.
- Плавающий фундамент. Строится на пучинистых почвах, несущие свойства которых отличается от сезона, насыщенности влагой и температурного режима. Конструкция: монолитная или решетчатая плита, толщина зависит от нагрузки самого здания. Используется для небольших сооружений.
 Схема столбчатого фундамента под деревянный дом
Схема столбчатого фундамента под деревянный дом- Ленточный и столбчатый фундаменты. Это распространенные стационарные основания, пользуются заслуженной популярностью среди частных застройщиков. Столбчатая конструкция незаменима на глубоко промерзаемых почвах. Не рекомендуется его использовать при строительстве домов с тяжелыми стенами, ведь тогда нужно проводить подробные расчеты несущей нагрузки на каждый столб индивидуально. А это несет за собой расчет толщины, высоты и типа столба, а также материала его выполнения. Особенность ленточного фундамента в том, что цоколь там плавно переходит в стены, а нагрузка от стен и перекрытий передается равномерно на каждый квадратный сантиметр основания. Ленточное основание способно выдержать значительные нагрузки, можно построить полноценный подвал или технический этаж, а также подземный паркинг. Его нужно возводить на сухих непучинистых грунтах, ведь при установке основания на глубоко промерзающих грунтах его постройка будет очень дорогой и экономически не выгодной.
- Фундамент на винтовых сваях. Он появился относительно недавно, раньше применялся в промышленности для возведения оснований для высоковольтных линий электропередач, некоторых промышленных зданий, а также мачт сотовой связи. Но плавно такая технология перешла в частный сектор и активно используется при возведении зданий на сложных почвах. Отличительная особенность свайной конструкции – это возможность монтажа свай на значительной глубине, ведь она вкручивается до тех пор, пока не достигнет плотных пород.
Винтовая свая – это металлическая конструкция с лопастями, которая вкручивается в грунт специальной техникой или вручную.
Как правило, расчет проводится не столько количества этих дешевых строительных конструкций, как нагрузки на ростверк, с помощью которого сваи соединяются между собой. Также свайный фундамент возводится на поверхностях с большими перепадами высот, ведь тут не нужно проводить первичную обработку и выравнивание почвы.
Но основной недостаток свайного фундамента – это необходимость делать теплоизоляцию подполья, а это сложная технология, учитывая наличие открытого пространства снизу. Монтаж свай занимает максимум несколько дней, при этом не нарушается структура самой почвы. Не используется при возведении зданий на скалистых почвах.
После монтажа свай их внутренняя полость заполняется бетоном с целью увеличить прочность и допустимую нагрузку.
Конструкция различных типов фундаментов
 Виды ленточных фундаментов
Виды ленточных фундаментов- Ленточный. Это сборная или монолитная железобетонная конструкция, делается на всему периметру будущего здания под несущими стенами. Ленточные фундаменты бывают заглубленными (нижняя кромка устанавливается на граничном уровне промерзания), малозаглубленными (нижняя кромка выше глубины промерзания). Заглубленные основания считаются оптимальными для зданий с высокими нагрузками на грунт, ведь фундамент стойкий к воздействию со стороны почвы. Конструкция состоит из монолитных плит или готовых железобетонных блоков, которые укладываются по периметру несущих стен, а также на их пересечении, соединяются между собой арматурой. Стоит такое основание недешево, но выдерживает большие нагрузки, а за счет монолитности конструкции даже при средних подвижках сдвигается все здание, а не его часть.
- Столбчатый. Часто его используют для экономии материалов при возведении оснований на слабопучинистых почвах. Если используются только столбы, тогда лучше несущие стены из ленточных бетонных блоков делать по стыкам на столбах. А если столбчатая конструкция используется на пучинистых слабых почвах, тогда столбы между собой соединяются жестким железобетонным армированным ростверком. Тут ключевой элемент – это столб, который углубляется на глубину ниже уровня промерзания, в качестве несущей конструкции используется асбестовая труба, внутри устанавливается арматура, делается обвязка и все заливается бетоном.
 Варианты винтового фундамента для строительства различных конструкций
Варианты винтового фундамента для строительства различных конструкций- Свайные фундаменты. Их сразу можно подразделить по конструкции и типу выполнения свай на забивные, трубобетонные, буронабивные, винтовые и другие конструктивные разновидности. Соответственно, конструкция отличается в зависимости от способа установки свай, их типа, материала выполнения, прочих параметров. Все сваи нужно между собой соединить армированием в виде металлической обвязки или железобетонного ростверка. Также можно делать деревянную обвязку, но она рассчитана на небольшие нагрузки. Такой фундамент незаменим при возведении зданий на рельефной территории, ведь земляные работы будут стоить дороже использования даже металлических или бетонных свай.
- Плитные фундаменты. Это фактически монолитная железобетонная плита, расположенная под стенами здания и она монтируется по всей площади будущего сооружения. Это дорогое удовольствие, ведь на сооружение плиты пойдет много цемента, песка, щебня и арматуры. Но такая плита гарантирует плавность всего здания, ведь при сейсмических воздействиях сползать будет только плита, а не отдельные ее элементы.
- Континуальные фундаменты. Это основания специального назначения, используются при возведении мостов, бункеров, больших промышленных объектов. Конструкция оснований подбирается под каждое сооружение индивидуально, отличается множеством параметров, а также призвана передавать равномерно массу сооружения на всю поверхность почвы. Толщина и наполнение плит во многом зависит от назначения, поэтому в частном строительстве практически не используется.
Как подобрать оптимальную конструкцию будущего фундамента
 Тут многое зависит от финансовых возможностей застройщика и ключевых характеристик будущего здания. Ведь на одном и том же грунте можно возвести сразу несколько вариантов фундаментов, но они будут отличаться конструкцией и финансовыми составляющими. Соответственно, при выборе конструкции фундамента стоит обращать внимание на следующие параметры:
Тут многое зависит от финансовых возможностей застройщика и ключевых характеристик будущего здания. Ведь на одном и том же грунте можно возвести сразу несколько вариантов фундаментов, но они будут отличаться конструкцией и финансовыми составляющими. Соответственно, при выборе конструкции фундамента стоит обращать внимание на следующие параметры:
- Совместимость выбранной конструкции из существующим типом почвы;
- Наличие или отсутствие сейсмических зон;
- Протяженность различных источников мощной вибрации;
- Наличие поблизости памятников архитектуры;
- Температурные факторы промерзания грунта, а также влажность климата, глубина погружения и расположения грунтовых горизонтов;
- Наличие поблизости промышленных предприятий, которые часто сбрасывают сточные воды, загрязненные агрессивными веществами.
Какую конструкцию фундамента не использовать, все равно нужно обязательно сделать гидроизоляцию и теплоизоляцию основания. Без этих действий нельзя получить качественное и долговечное основание, способное выполнять свои основные функции.
Основания — классификация, получение и свойства » HimEge.ru
Основаниями называют гидроксиды, которые диссоциируют (распадаются) на гидроксильную группу и положительно заряженный катион.
Общая формула оснований — Э(OН)m, где m – степень окисления металла.
Классификация оснований
Взаимодействие активных металлов с водой (только щелочи)
2Na + 2H2O = 2NaOH + H2,
Ba + 2H2O = Ba(OH)2 + H2,
Взаимодействие основных оксидов с водой (только щелочи)
Na2O + H2O = 2NaOH,
Взаимодействие солей со щелочами (малорастворимые основания)
CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4,
Cu2+ + 2OH— = Cu(OH)2,
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl,
Al3+ + 3OH— = Al(OH)3.
Электролиз водных растворов солей (промышленный способ)
2NaCl + 2H2O = 2NaOH + H2 + Cl2.
1) Растворы оснований мыльные на ощупь, изменяют окраску индикаторов: лакмуса – в синий цвет, бесцветного фенолфталеина – в малиновый.
В водном растворе растворимые основания диссоциируют, образуя катион металла и гидроксогруппу:
NaOH = Na+ + OH—.
Многоосновные основания диссоциируют ступенчато:
Ba(OH)2 = BaOH+ + OH—,
BaOH+ = Ba2+ + OH—,
суммарное уравнение:
Ba(OH)2 = Ba2+ + 2OH—.
2) Взаимодействие с кислотами (реакция нейтрализации)
NaOH + HCl = NaCl + H2O,
OH— + H+ = H2O.
При реакции нейтрализации взаимодействие сводится к взаимодействию ионов водорода и гидроксогруппы с образованием малодиссоциирующего вещества – воды.
Многоосновные основания образуют основные и средние соли:
Ba(OH)2 + HCl = BaOHCl + H2O,
Ba(OH)2 + 2HCl = BaCl2 + 2H2O.
3) Взаимодействие с кислотными оксидами
Ca(OH)2 + CO2 = CaCO3 + H2O,
4) Взаимодействие с солями
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3 + 3Na2SO4,
2Fe3+ + 6OH— = 2Fe(OH)3.
5) Термическое разложение
Cu(OH)2 = CuO + H2O,
2Fe(OH)3 = Fe2O3 + 3H2O .
Щелочи термическому разложению не подвергаются, например, гидроксид натрия кипит при 1400°С без разложения, из всех растворимых оснований разлагается только гидроксид лития:
2LiOH = Li2O + H2O.
6)Взаимодействие с неметаллами
6KOH + 3S = K2SO3 + 2K2S + 3H2O,
2NaOH + Cl2 = NaCl + NaOCl + H2O (на холоде).
Общая характеристика оснований — урок. Химия, 8–9 класс.
В \(1754\) году французский химик Г. Руэль (\(1703\)–\(1770\)) ввёл термин «основание», подразумевая, что к соединениям данного класса относится любое вещество, которое способно взаимодействовать с кислотами, образуя соли.
Гийом Франсуа Руэль
\(1703\)–\(1770\)
Позже значение этого термина неоднократно уточнялось. Одно из определений, которым пользуются в настоящее время, звучит так:
Основаниями называют сложные вещества, в состав которых входят металлические химические элементы, соединённые с одной или несколькими гидроксогруппами (группами атомов \(-OH\)).
Исходя из этого, общую химическую формулу оснований можно изобразить следующим образом:
M(OH)n,
где \(M\) — знак металлического химического элемента,
а \(n\) — индекс, численно совпадающий с валентностью металла.
Основания относятся к электролитам, то есть к веществам, растворы и расплавы которых проводят электрический ток.
С точки зрения теории электролитической диссоциации, основания — электролиты, которые, диссоциируя, из отрицательно заряженных ионов образуют только гидроксид-ионы.
Номенклатура оснований
Название основания состоит из слова «гидроксид» и названия металлического химического элемента в родительном падеже. Если металлический элемент имеет переменную валентность, то последняя указывается римскими цифрами в скобках без пробела сразу же после названия металла.Пример:
NaOH — гидроксид натрия,
Fe(OH)2 — гидроксид железа(\(II\)),
Fe(OH)3 — гидроксид железа(\(III\)).
Классификация оснований
Растворимые в воде основания называют щелочами.
По их способности растворяться в воде основания делят на растворимые и практически нерастворимые.
Примеры: NaOH — гидроксид натрия, KOH — гидроксид калия, Ca(OH)2 — гидроксид кальция. | Примеры: Cu(OH)2 — гидроксид меди(\(II\)), Fe(OH)2 — гидроксид железа(\(II\)), Fe(OH)3 — гидроксид железа(\(III\)). |

